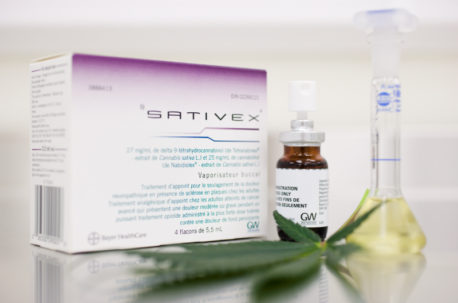
Por primera vez en el país, fue aprobado por parte del Instituto de Salud Pública de Chile (ISP) el registro sanitario de un medicamento fabricado con base a cannabis, el cual podrá ser distribuido y utilizado en Chile. Se trata de Sativex, fármaco del Laboratorio Biopas S.A. y que es fabricado por GW Pharma, Kent Science Park del Reino Unido. El medicamento ya se encuentra aprobado en países como Reino Unido, Alemania, España, Colombia y ahora en Chile.
“El registro sanitario de Sativex fue aprobado ya que cumple con todos los requisitos reglamentarios de calidad, y ha demostrado su seguridad y eficacia en la indicación solicitada. Es un medicamento para el tratamiento de los síntomas en pacientes adultos con espasticidad moderada o grave debida a la esclerosis múltiple, que no han respondido de forma adecuada a otros medicamentos antiespásticos”, comentó el director del ISP, Alex Figueroa.
El medicamento corresponde a una solución para nebulización bucal en base a extractos estandarizados de hojas y flores de Cannabis sativa L., la que se presenta en un frasco con dispositivo pulverizador.
La aprobación el producto se logró tras un decreto emitido por el gobierno en diciembre de 2015, que modificó la regulación sanitaria, al pasar el estupefaciente de la lista I a la IV. Su condición de venta es bajo receta médica retenida con control de existencia, conforme a lo establecido en el inciso final del art. 23°, del D.S. N° 404/83.
“El laboratorio solicitó tres presentaciones, venta público, muestra médica y envase clínico, autorizándose la venta al público y en envase clínico, ya que no es posible autorizar muestras médicas (art. 34° del D.S. N° 404/83) para productos estupefacientes, debido a que el principio activo es Cannabis sativa L., se encuentra incluido actualmente en la lista II del citado decreto”, comentó el Figueroa.
INDICACIONES
Para el uso de Sativex, es necesario un período de ajuste de la dosis para alcanzar la dosis óptima. La cantidad y hora de las pulverizaciones variarán según el paciente, y si no se observa una mejoría clínicamente significativa de los síntomas relacionados con la espasticidad durante el periodo inicial de prueba, deberá suspenderse el tratamiento.
No se recomienda el uso de Sativex en niños o adolescentes menores de 18 años de edad debido a la ausencia de datos sobre seguridad y eficacia. Tampoco se recomienda su uso en pacientes con enfermedad cardiovascular grave. De igual forma, se debe tener cuidado al tratar a pacientes con antecedentes de epilepsia o crisis recurrentes hasta que no se disponga de más información.
Con su uso, a menudo se notifican mareos leves o moderados, lo que suele ocurrir en las primeras semanas de tratamiento. Otra consideración a tener con el medicamento, es que es posible que los pacientes con antecedentes de abuso de sustancias sean más propensos a abusar también de Sativex.
Está contraindicado para pacientes con hipersensibilidad a los cannabinoides o a alguno de los excipientes propilenglicol, etanol anhidro, esencia de mental. Pacientes con antecedentes personales conocidos o sospechados o antecedentes familiares de esquizofrenia u otras enfermedades psicóticas, antecedentes de trastorno grave de la personalidad u otros trastornos psiquiátricos importantes distintos de la depresión asociada a la enfermedad subyacente. En mujeres en período de lactancia, debido a la probabilidad de niveles considerables de cannabinoides en la leche materna y a los posibles efectos adversos en el desarrollo del lactante.