La farmacéutica alemana Merck anunció la semana pasada que solicitará a las autoridades sanitarias de EE. UU. la autorización de su pastilla experimental que redujo a la mitad el riesgo de hospitalización o muerte en los pacientes contagiados de COVID-19 que participaron en el ensayo clínico de la compañía.
Merck y la empresa de biotecnología Ridgeback Biotherapeutics, los creadores del fármaco llamado molnupiravir, realizaron un estudio en el que participaron 775 pacientes con un contagio de leve a moderado, pero con mayor probabilidad de una mala evolución de la enfermedad debido a problemas de salud, como obesidad, diabetes o enfermedades cardiovasculares, de los cuales unos recibieron molnupiravir y otros, placebo.
Entre los pacientes que tomaron molnupiravir, el 7,3 % fueron hospitalizados o murieron al cabo de 30 días en comparación con un 14,1 % de los que recibieron placebo. Después de ese período, no se registraron muertes entre el grupo que recibió la pastilla de molnupiravir, mientras que hubo ocho fallecidos entre los que tomaron placebo.
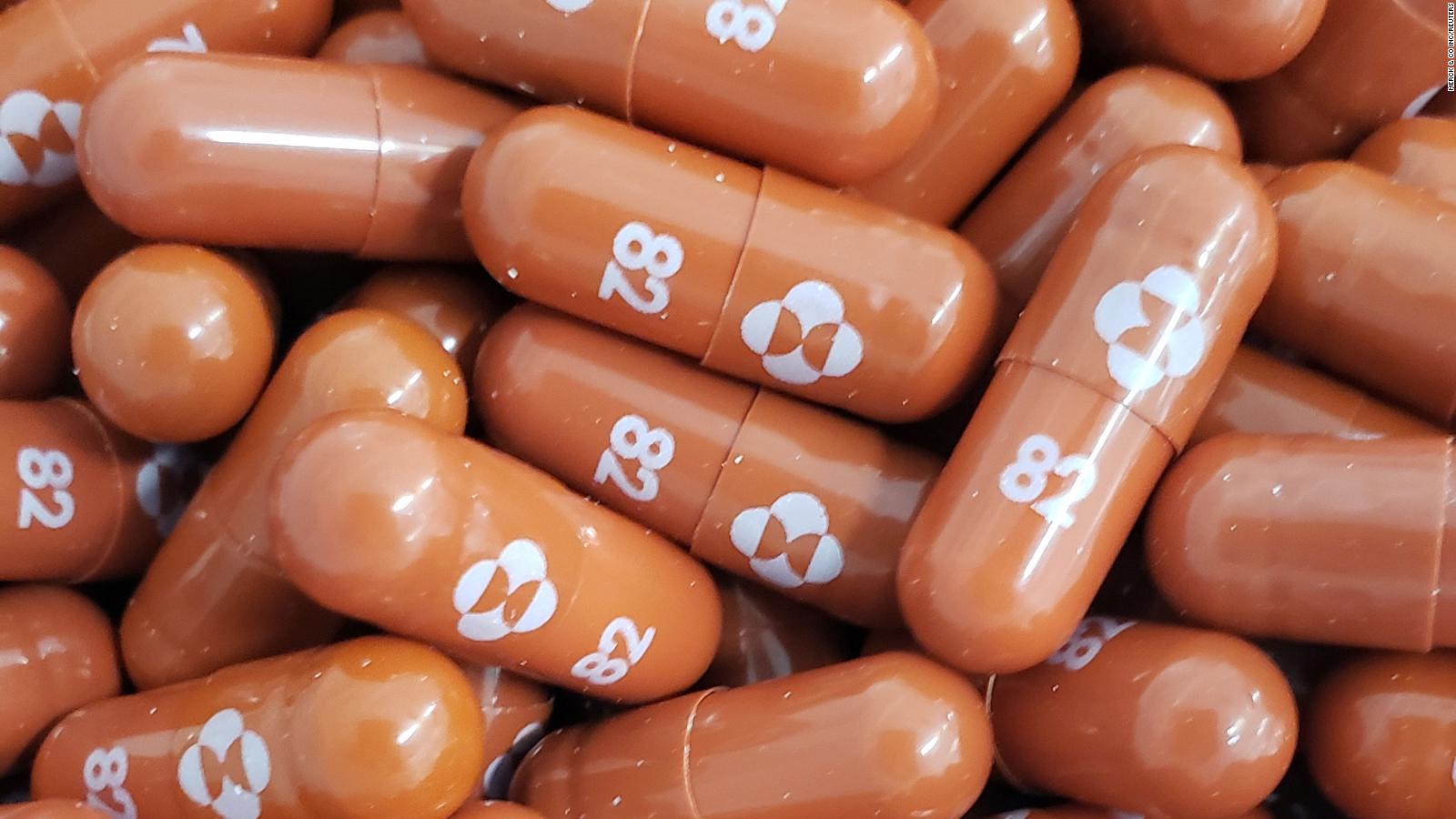
«Dado que el virus sigue circulando ampliamente, y que las opciones terapéuticas disponibles en la actualidad se administran mediante inyección y requieren asistencia a un centro sanitario, se necesitan urgentemente tratamientos antivirales que puedan tomarse en casa para mantener a las personas contagiadas con COVID-19 fuera del hospital», dijo el director ejecutivo de Ridgeback Biotherapeutics, Wendy Holman.
Según el comunicado, el Gobierno de Estados Unidos ya compró 1,7 millones de dosis del medicamento, que podría ser el primer antiviral contra el coronavirus de uso oral, por 1.200 millones de dólares. Asimismo, Merck, que planea fabricar 10 millones de pastillas antes de fin de año, ha firmado acuerdos de suministro y compra de molnupiravir con otros Gobiernos de todo el mundo, a la espera de la autorización reglamentaria.
Fuente: RT.